بقیه در ادامه مطالب
برگرفته شده از وبلاگ: 9hoom.blog.ir
پیوند کوالانسی : پیوند
اتمی نوعی نیروی ربایش است که اتم های یک ماده را در کنارهم قرار می دهد و
پیوند کوالانسی جاذبه ای است که اتم های یک مولکول را کنار هم نگه می دارد
و مولکول های کوچک و بزرگ را به وجود می آورد.
این پیوندبا به اشتراک
گذاشتن دو الکترون لایه ی آخر به وجود می آید. الکترونهای اشتراکی به هر
دو اتم تعلق دارد.مثلا مولکول هیدروژن 2 اتمی است. هر اتم هیدروژن با به
اشتراک گذاشتن تنها الکترون خود الکترونهای لایه خود را کامل می کند .
به ماده ای که ذره های سازنده ی آن مولکول ها هستند ، ترکیبات مولکولی گفته می شود.
ترکیبات مولکولی به صورت مولکول های مجزا در هر سه حالت جامد ، مایع و گاز وجود دارند و پیوند کوالانسی بین این مولکول ها برقرار است .
یون : ذره ای با بار الکتریکی مثبت و یا منفی که با از دست دادن الکترون ها و یا به دست آوردن آن ها در یک اتم وجود دارد.
یون ها مانند اتم ها خنثی نیستند زیرا برخلاف اتم ها دارای پروتون ها و الکترون های برابری نمی باشند.اگر تعداد پروتون ها بیشتر باشد یون مثبت و اگر تعداد الکترون ها بیشتر باشد یون منفی است.
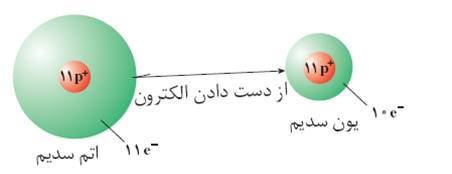
یون مثبت : به اتمی که الکترون از دست بدهد یون مثبت می گویند.مانند اتم سدیم که با از دست دادن الکترون به یون منفی تبدیل می شود.
در شکل اتم سدیم که 11پروتون و 11 الکترون دارد با از دست دادن یک الکترون خود تبدیل به یون سدیم (یون مثبت )با 11پروتون و 10 الکترون شده است.
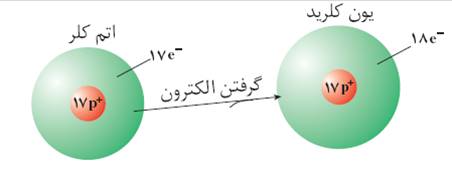
یون منفی :به اتمی که الکترون از بگیرد یون منفی می گویند. مانند اتم کلر که با ازگرفتن الکترون به یون منفی تبدیل می شود.
در شکل اتم کلر که 17پروتون و 17 الکترون دارد با گرفتن یک الکترون تبدیل به یون کلرید (یون منفی )با 17پروتون و 18 الکترون شده است.
نکته : برای نامیدن یون های منفی پسوند ید به آنها اضافه می گردد. به طور مثال در شکل بالا به یون منفی کلر ، یون کلرید می گویند.
اثر یون ها بر یکدیگر:یون ها نیز مانند قطب های آهنربا عمل می کنند بدین صورت که بارهای همنام همدیگر دفع می کنند و بارهای ناهمنام همدیگر را جذب می کنند.
ترکیبات یونی : به ماده ای که یون های مثبت ومنفی ذره های سازنده ِآن هستند ترکیب یونی گفته می شود.مانند نمک خوراکی یا NaCl
پیوند یونی : نوعی پیوند شیمیایی که یون ها محکم کنار هم نگه داشته است و ترکیبات یونی را به وجود آورده است.
در ترکیبات یونی ، پیوند های یونی به راحتی در آب شکسته می شوند و مولکول های آب سبب جدا شدن این یون ها و پراکنده شدن آن ها در محلول می شوند.بدین ترتیب با پراکنده شدن این ذرات رسانایی الکتریکی محلول تغییر می کند.به محلول حاصل الکترولیت می گویند.
منبع: درجستجوی علوم
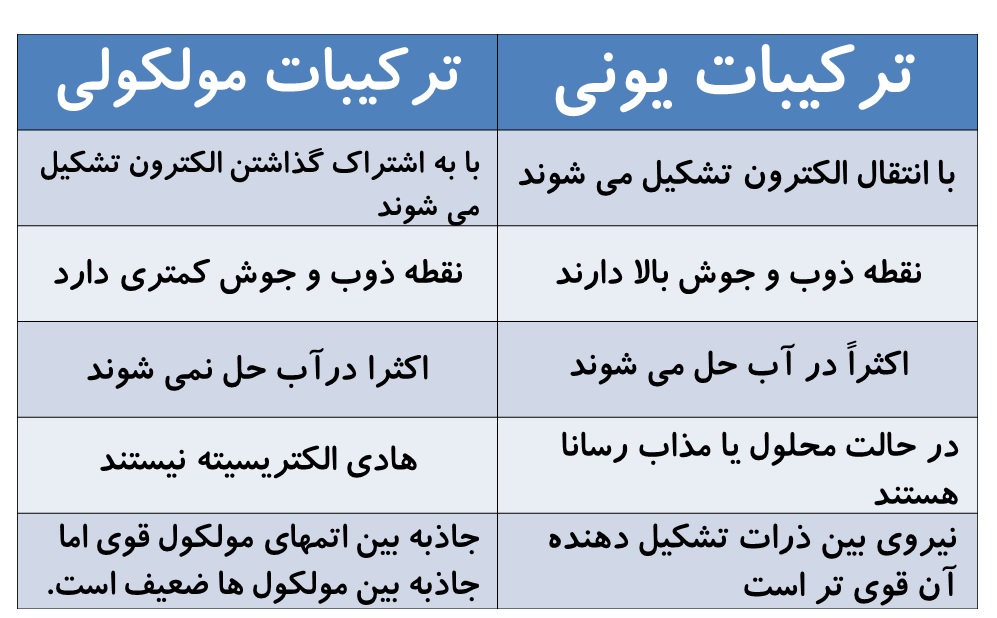
مقایسه ترکیبات مولکولی با ترکیبات یونی
|
ترکیبات یونی |
ترکیبات مولکولی
|
|
با انتقال الکترون تشکیل می شوند |
با به اشتراک گذاشتن الکترون تشکیل می شوند |
|
نقطه ذوب و جوش بالا دارند |
نقطه ذوب و جوش کمتری دارد |
|
اکثراً در آب حل می شوند |
اکثرا درآب حل نمی شوند |
|
در حالت محلول یا مذاب رسانا هستند |
هادی الکتریسیته نیستند |
|
نیروی بین ذرات تشکیل دهنده آن قوی تر است |
جاذبه بین اتمهای مولکول قوی اما جاذبه بین مولکول ها ضعیف است. |




